Глобулярные и фибриллярные белки. Типы фибриллярных белков
Человеческий организм вмещает больше пятидесяти тысяч белков, которые разнятся между собой по структуре, строению и функциям. Они состоят из разных аминокислот, каждая из них занимает свое положение в цепи полипептидов. На сегодняшний день не существует единой классификации, которая учитывает разные параметры белков. Одни из них отличаются по форме молекул, здесь выделяют глобулярные и фибриллярные белки , о них и пойдет сегодня речь.
Белки глобулярные
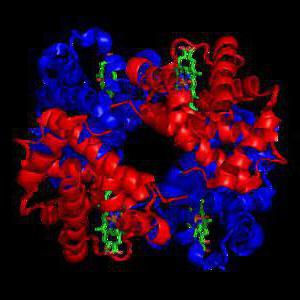
Сюда относятся белки такие, в чьих молекулах наблюдаются цепи полипептидов, что имеют шароподобную форму. Такое строение белка связано с гидрофильными (имеют соединения водорода с водой) и гидрофобными (отталкивают воду) взаимодействиями. К данному виду относятся экзимы, гормоны, которые имеют белковую природу, иммуноглобулины, протеиды, альбумины, а также белки, которые выполняют регуляторную и транспортную функции. Это большая часть белков человека.
Экзимы
Экзимы (ферменты) находятся во всех клетках, с их помощью одни вещества превращаются в иные, так как они резко изменяют скорость превращений, способствуя распаду, расщеплению и синтезу веществ из продуктов распада. Во всех протекающих в организме реакциях они играют роль катализатора, регулируют обмен веществ. Известно более пяти тысяч разных ферментов. Все они выполняют до нескольких миллионов действий в секунду. Но они способствуют ускорению определенных реакций, оказывая действие только на определенные вещества. Ферменты удаляют погибшие клетки, шлаки и яды. Они являются катализаторами всех процессов в организме, а если их недостаточно, то у человека увеличивается вес за счет накопления отходов в теле.
Иммуноглобулины
Антитела (иммуноглобулины) представляют собой соединения белков, что появляются вследствие ответной реакции на поступление в организм бактерий и вирусов, а также токсинов. Они не дают им размножаться и нейтрализуют отравляющие вещества. Иммуноглобулины распознают и связывают чужеродные вещества, их уничтожают, образуя иммунные комплексы, а потом удаляют эти комплексы. Также они защищают организм от повторного инфицирования, так как антитела против болезней, которые были перенесены, длительный период сохраняются. Иногда в организме вырабатываются аномальные антитела, что нападают на собственный организм. Происходит это чаще всего из-за наличия аутоиммунных болезней. Таким образом, глобулярные и фибриллярные белки выполняют незаменимые функции в организме человека, поддерживая его нормальную жизнедеятельность.
Гормоны белковой природы
Сюда относятся гормоны поджелудочной, паращитовидной желез и гипофиза (инсулин, глюкагон, СТГ, ТТГ и другие). Одни регулируют углеводный обмен, увеличивая и понижая уровень сахара в крови, другие стимулируют рост клеток и деятельность щитовидной железы, третьи проводят регуляцию половых желез. Таким образом, все они регулируют физиологические функции. Эта их работа сводится либо к ингибированию, либо к активации систем ферментов.
Белки фибриллярные
Фибриллярные белки те, что имеют структуру в виде нити. Они не растворяются в воде и имеют массу молекулы очень большую, структура которой высокорегуляторная, она приходит в устойчивое состояние благодаря взаимодействиям между разными цепями полипептидов. Эти цепи находятся синхронно друг для друга на одной плоскости и создают так называемые фибриллы. К фибриллярным белкам относятся : кератины (волосы и иные роговые покровы), эластин (сосуды и легкие), коллаген (сухожилия и хрящи). Эти все белки выполняют в организме структурную функцию. Также сюда входит миозин (мышечное сокращение) и фибрин (свертывание крови). Этот вид белков выполняет опорные функции, которые придают прочности тканям. Таким образом, все типы фибриллярных белков выполняют незаменимую роль в анатомии и физиологии. Из них образуются защитные покровы человека, также они принимают участие в создании опорных элементов, поскольку входят в состав соединительной ткани, хрящей, сухожилий, костей и глубоких кожных слоев. В воде они не растворяются.
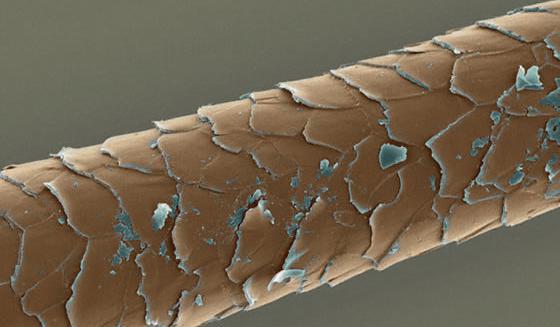
Кератины
К фибриллярным белкам относятся кератины (альфа и бета). Альфа-кератины представляют собой основную группу фибриллярных белков, из них формируются покровы, которые выполняют защитную функцию. Они представлены в сухом весе волос, ногтей, перьев, шерсти, панцирей и так далее. Разные белки имеют сходство в составе аминокислот, они содержат цистеин и имеют цепи полипептидов, которые располагаются одинаково. Бета-кератины содержат аланин и глицин, они входят в состав паутины и шелка. Таким образом, кератины бывают «твердыми» и «мягкими».
В ходе возникновения различий между эпителиальными клетками, в процессе развития особи, они ороговевают, в них приостанавливается обмен веществ, наступает угасание клетки и она ороговевает. Клетки кожи вмещают кератин, он совместно с коллагеном и эластином образует влагонепроницаемый слой эпидермиса, кожа становится упругой и прочной. При натирании и давлении клетки вырабатывают кератин в огромных количествах с защитной целью. Вследствие этого появляются мозоли или наросты. Ороговевшие клетки кожи начинают беспрерывно отшелушиваться и заменяются новыми. Таким образом, бета-кератины играет большую роль для животного мира, так как представляют собой основной компонент рогов и клювов. Альфа-кератины характерны для организма человека, они являются составной частью волос, кожи и ногтей, а также входят в костный скелет, определяя его крепость.
Коллаген
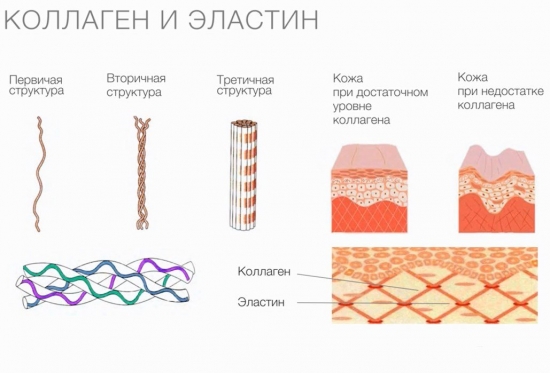
Фибриллярные белки , в частности коллаген с эластином, являются компонентами соединительной ткани, они составляют основную долю хрящей, стенок сосудов, сухожилий и прочего. Коллаген представлен у позвоночных третьей частью всей массы белков. Его молекулы производят полимеры, которые называются коллагеновыми фибриллами. Они очень прочны, выдерживают огромную нагрузку и не растягиваются. Коллаген состоит из глицина, пролина и аланина, в нем нет цистеина и триптофана, а тирозин и метионин присутствуют здесь в малом количестве.
Также большую роль в образовании фибрилл играют гидроксипролин и гидроксилизин. Изменения в строении коллагена приводят к развитию наследственных заболеваний. Коллагены очень прочны, они не растягиваются. Для каждой ткани присущи свои типы коллагенов. Этот белок выполняет множество функций:
- защитную, характеризующуюся обеспечением прочности тканей и их защитой от травм;
- опорную, обусловленную скреплением органов и формированием их форм;
- восстановительную, характеризующуюся регенерацией на клеточном уровне.
Также коллагены придают тканям эластичности, предотвращают развитие меланом кожи, участвуют в образовании оболочек клеток.
Эластин
Выше мы рассмотрели, какие белки относятся к фибриллярным . Еще сюда включают эластин, что имеет резиноподобные свойства. Его нити, которые находятся в легочной ткани, сосудистых стенках и связках, могут растягиваться во много раз больше своей обычной длины. После того, как нагрузка прекращает свое воздействие, они возвращаются в первичное положение. В составе эластина больше всего содержится пролина и лизина, гидроксилизина здесь нет. Таким образом, функции фибриллярных белков очевидны. Они играют большую роль в развития организма. Эластин обеспечивает растяжение и сжатие органов, артерий, сухожилий, кожи и прочего. Он помогает органам восстанавливать первоначальные размеры после растяжения. Если в организме человека недостает эластина, то у него образуются кардиоваскулярные изменения в виде аневризм, дефектов клапанов сердца и так далее.
Сравнение глобулярных и фибриллярных белков
Эти две группы белков разнятся между собой по форме молекул. Глобулярные белки имеют цепи полипептидов, что скручены очень плотно в овальные структуры. Ф ибриллярные белки имеют цепи полипептидов, которые находятся параллельно друг другу и образуют слой. По механическим свойствам ГБ не сжимаются и не распрямляются, а ФБ, наоборот, имеют такую способность. ГБ не растворяются в воде, а ФБ растворяются. Также эти белки разнятся по своим функциям. Первые выполняют функцию динамическую, а вторые – структурную. Глобулярные белки могут быть представлены в виде ферментов и антител, а также гемоглобина, инсулина и прочего. Примеры фибриллярных белков: коллаген, кератин, фиброин и прочие. Все эти виды белков незаменимы, недостаточное их количество в организме приводит к серьезным нарушениям и патологиям.
Таким образом, глобулярные и фибриллярные белки выполняют незаменимую роль в нормальной жизнедеятельности организма позвоночных. Они обеспечивают деятельность органов, тканей, кожи и прочего, выполняют множество функций, необходимых для полноценного развития организма.
Источник статьи: http://fb.ru/article/339575/globulyarnyie-i-fibrillyarnyie-belki-tipyi-fibrillyarnyih-belkov
Фибриллярный белок: структура, примеры
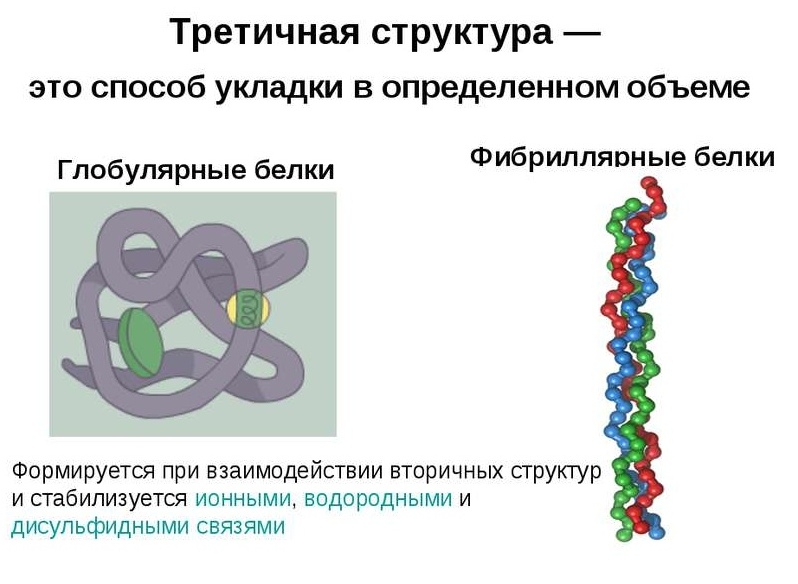
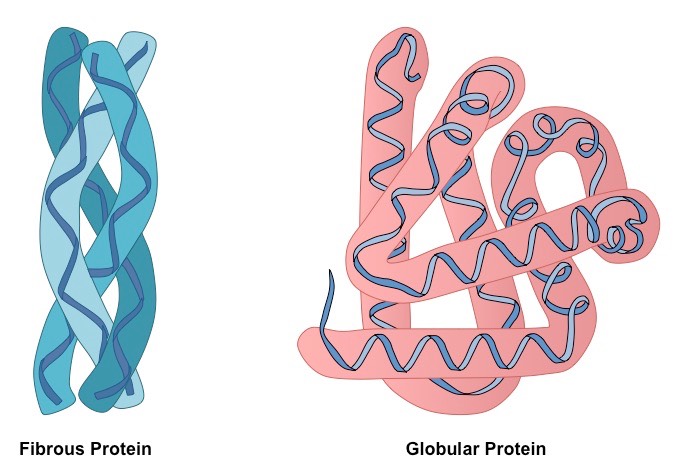
По особенности укладки в трехмерном пространстве различают две большие группы белков: глобулярные и фибриллярные. Большинство протеинов относится к первой фракции, которая соответствует типичной модели третичной структуры, описывающей аминокислотную цепь как сферический клубок с гидрофобным центром и гидрофильной поверхностью. Фибриллярные белки — это специфическая группа, характеризующаяся нитевидной формой молекул.
Общая характеристика пространственной структуры белка
В первоначальном виде синтезированный белок представляет собой линейную цепочку аминокислот, соединенных друг с другом пептидными связями. Однако на пути к конечной функциональной форме молекула претерпевает несколько стадий пространственной укладки за счет различных химических взаимодействий. Каждый этап формирования обозначен соответствующими структурами: первичной, вторичной, третичной и четвертичной (если имеется).
Глобулярные белки характеризуются трехмерной пространственной конформацией, которая удерживается комплексом слабых химических связей (водородные, ионные, гидрофобные и т. д.). По форме молекула такого протеина напоминает сферический клубок.
Полипептидные цепи фибриллярных белков формируют длинные волокна, которые состоят из повторяющихся элементов вторичной структуры. Устройство третичной конформации нитевидных протеинов по сравнению с глобулой значительно примитивнее, однако обеспечивает хорошую стабильность.
Основные отличия нитевидных белков от сферических
Кроме пространственной формы, фибриллярные белки отличаются от глобулярных по:
Волокнистые протеины обычно крупнее сферических и представляют собой длинные стержни, сформированные из спиралей. В отличие от глобулярных белков, пространственная конформация фибриллярных обеспечивается за счет сильных водородных связей. По этой причине волокнистые протеины более стабильны и не так легко денатурируют, как сферические.
В отличие от глобулярных белков, фибриллярные:
- не растворяются в воде, а также слабых кислотах и основаниях;
- растворимы в сильных щелочах и кислотах;
- обладают свойствами растяжимости и сжатия;
- характеризуются высокой устойчивостью к пищеварительным ферментам.
Глобулярные белки построены из прямых участков вторичных структур, которые при соединении друг с другом резко меняют направление, формируя трехмерный клубок. Волокнистые протеины состоят из одного элемента, повторяющегося много раз.
Особенности фибриллярных протеинов
Разнообразие фибриллярных белков значительно меньше, чем глобулярных. Эта группа представляет собой специализированную фракцию протеинов, выполняющих преимущественно структурные функции. При этом фибриллярные белки работают на макроуровне, формируя крупные надмолекулярные комплексы.
Волокнистые протеины были идентифицированы только у животных. Эти белки выполняют функцию опорных компонентов некоторых тканей. Такая биологическая роль предъявляет повышенные требования к прочности и упорядоченности построения молекул. По этой причине фибриллярная структура белка отличается большей стабильностью по сравнению с глобулой.
Волокнистые протеины участвуют в формировании жестких структур, таких как:
- соединительная ткань;
- сухожилия;
- мышечные волокна.
Эти белки входят в состав различных покровных образований (эпидермис, волосы, шерсть и т. д.), выполняя защитные функции.
В естественной физиологической среде фибриллярные белки не присутствуют в растворе. Однако, если искусственно смешать молекулы волокнистого протеина с водой, образуется очень вязкая масса.
Примеры фибриллярных и глобулярных белков
К глобулярным белкам можно отнести все протеины, растворенные в межклеточной и внутриклеточной средах, а также в плазме крови. Сюда относят ферменты, белковые гормоны, факторы транскрипции, иммуноглобулины и так далее. Классическим образцом глобулярного белка можно назвать гемоглобин.
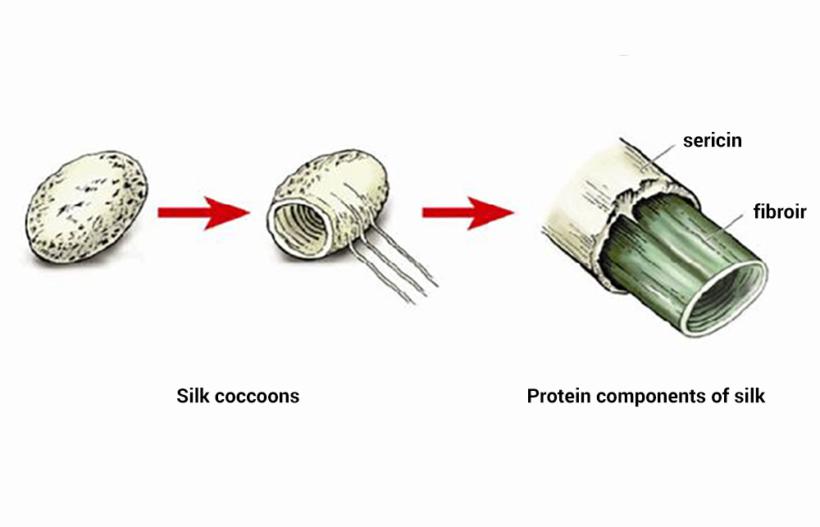
Сферические протеины выполняют множество функций, тогда как волокнистые — только структурную. Типичным примером фибриллярных белков являются коллаген, эластин и кератины. К группе волокнистых протеинов относят также фиброин, из которого состоит шелковая нить, и фибрин, формирующийся при полимеризации фибриногена в процессе свертывания крови.
Коллаген
Коллаген — самый распространенный фибриллярный протеин многоклеточных животных. Он входит в состав соединительной ткани, обеспечивая ее прочность и эластические свойства. Этот белок присутствует в:
- хрящах;
- дерме;
- сухожилиях;
- органическом матриксе костей;
- стенках сосудов;
- органическом материале костной ткани.
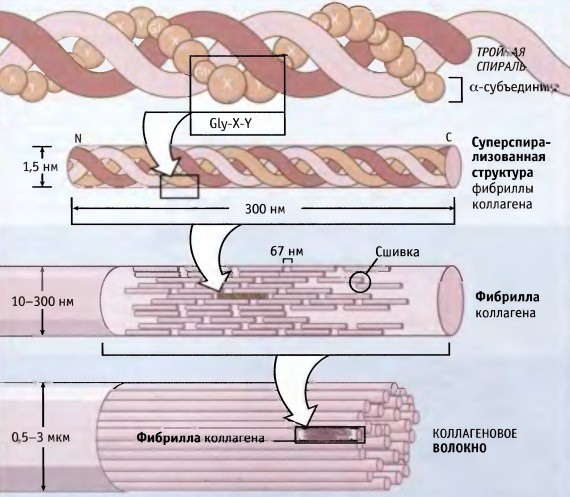
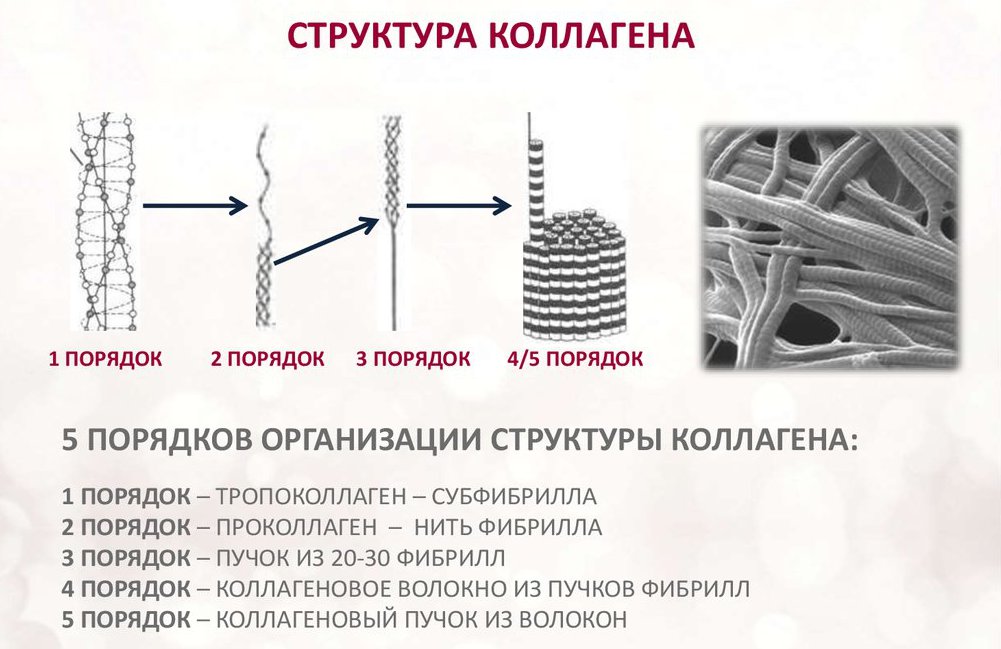
Коллаген состоит из трех аминокислотных цепей, скрученных в спираль и соединенных друг с другом ковалентными связями. Структурные единицы этого белка называются тропоколлагенами. Последние соединяются друг с другом концами, смещенными друг относительно друга на расстояние в 67 нанометров.
В зависимости от локализации в организме различают 28 типов коллагена. У всех разновидностей обязательно присутствует хотя бы один домен с тройной спиралью. Коллаген составляет основу всех типов соединительной ткани. Структурные компоненты этого белка образуют очень прочные фибриллы, которые способны выдерживать значительные нагрузки.
Коллаген выполняет опорные и защитные функции, а также обеспечивает эластичность тканей. Однако молекулы этого протеина не обладают способностью растягиваться. Резиноподобные свойства характерны для другого белка, также присутствующего в соединительных тканях, — эластина.
Кератины
Выделяют 2 основных разновидности кератинов: альфа и бета. В первую группу входят волокнистые белки, входящие в состав покровных образований позвоночных. Альфа-кератины составляют большую часть сухой массы:
- эпидермиса;
- волос и шерсти;
- когтей и ногтей;
- копыт, рогов, панцирей, игл и т. д.
Иными словами, кератины альфа-группы являются структурной основной для формирования производных кожи. Бета-разновидность этого типа волокнистых белков входит в состав паутины и шелка. Эти кератины более мягкие.
Жесткие белки альфа-группы выполняют защитные функции, а также обеспечивают прочность определенных анатомических частей (рога, копыта, клювы). За счет кератина происходит образование мозолей на поврежденной коже.
Эластин
Эластин — основной белковый компонент тканей, которые должны обладать высокими пластическими свойствами. Этот протеин входит в состав:
- артерий;
- легких;
- стенок мочевого пузыря;
- кожи;
- эластичных связок;
- хряща.
Как и другие фибриллярные белки, эластин строится из элементарных повторяющихся единиц. В этом случае в их качестве выступают небольшие молекулы весом 65 килодальтон, которые сшиваются с образованием нерастворимого комплекса. Каждая структурная единица называется протоэластином.
Источник статьи: http://www.syl.ru/article/434860/fibrillyarnyiy-belok-struktura-primeryi